Vorrei puntare l’attenzione su qualcosa che nella vecchia concezione della fisica si riteneva fosse “indivisibile” e cioè “l’atomo” (dal greco àtomos e cioè non divisibile). Con la fisica moderna molti concetti sono stati stravolti, tra questi il fatto che l’atomo fosse indivisibile, cosa ormai oggi chiaramente superata in quanto esso non è sicuramente la più piccola particella che compone la materia.
Se vogliamo spiegare cos’è la corrente elettrica non possiamo prescindere da questo piccolissimo mattoncino che compone la nostra materia, perché in esso sono racchiusi i concetti che maggiormente ci interessano, perciò addentriamoci subito nel vedere com’è la struttura di un atomo.
Oggi sappiamo che l’atomo è composto essenzialmente da 3 altre particelle, e cioè il protone, il neutrone e l’elettrone. I primi due hanno una massa quasi uguale (il neutrone ha massa 1,675 × 10−27 kg) mentre l’elettrone ha una massa circa 1800 volte più piccola degli altri due. Con la fisica moderna sono state scoperte oggi altre particelle ancor più piccole, ma non sono utili ai fini della nostra spiegazione.
Una piccola parentesi sul valore sopra menzionato e cioè 1,675 × 10−27 kg, se qualcuno ricorda le caratteristiche delle potenze sarebbe come scrivere:
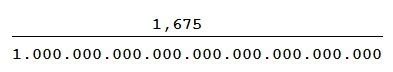
E cioè 1,675 diviso un miliardo di miliardi di miliardi il tutto in kg visto che stiamo parlando di massa.
Un’altra caratteristica che differenzia queste particelle oltre alla massa è la carica elettrica.
In fisica la carica elettrica è una grandezza scalare (e cioè una grandezza che viene rappresentata solo da un numero e non da una direzione o un verso come nel caso della forza o della velocità).
La carica elettrica è una proprietà fondamentale della materia come la massa. Ma mentre noi riusciamo a comprendere il significato della massa in quanto è una proprietà facilmente tangibile ed immaginabile, con la carica elettrica facciamo un po’ più di fatica.
Un corpo o una particella dotata di carica elettrica, fa sentire il suo effetto in una zona intorno a se che si chiama campo elettrico. Se ad esempio prendessimo un cantante famoso ed all’improvviso lo mettessimo con lo strumento in mano in mezzo ad una strada, sicuramente si comincerebbero ad adunare tante persone intorno al cantante, attratte dalla sua musica o dalla sua persona. Di fatto la strada è rimasta sempre quella, ma in quella zona c’è un elemento che fa risentire della sua presenza e che crea intorno a se un certo interesse e voglia di avvicinarsi.
La stessa cosa avviene con la carica elettrica, ci sono delle particelle che in natura hanno una proprietà simile, che è quella di far sentire la loro presenza senza fare assolutamente nulla. Ma la carica elettrica oltre ad essere una grandezza scalare ha un valore che può essere positivo o negativo, ed è ampiamente dimostrato che particelle con carica elettrica uguale si respingono mentre quelle con carica elettrica diversa si attraggono.
Nel sistema internazionale di misura la carica elettrica si misura in Coulomb [C].
Delle particelle prima menzionate che compongono l’atomo ce ne sono due che sono dotate di questa proprietà, il protone e l’elettrone.
Il protone ha carica elettrica positiva + e l’elettrone ha invece carica elettrica negativa –.
Il neutrone invece non possiede carica elettrica.
Inoltre la carica elettrica non dipende dalla massa della particella, infatti il protone (che ha una massa ben più grande dell’elettrone) ha una carica elettrica identica a quella dell’elettrone ma di segno opposto. Se vogliamo essere più precisi (ma a noi il valore non servirà) il protone ha una carica di +1,6022 × 10−19 Coulomb , mentre l’elettrone ha una carica di -1,6022 × 10−19 Coulomb.
Perciò l’elettrone che ha una massa circa 1800 volte più piccola del protone ha carica elettrica uguale ma negativa.
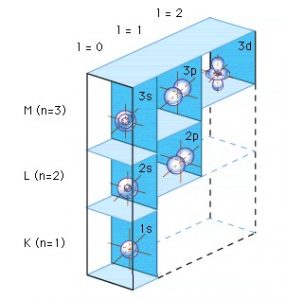
All’interno dell’atomo queste particelle sono disposte in modo che i protoni ed i neutroni (e cioè le particelle più grandi) siano aggregati insieme in una parte chiamata nucleo. Gli elettroni invece si trovano sempre in movimento intorno al nucleo, in delle zone chiamate orbitali.
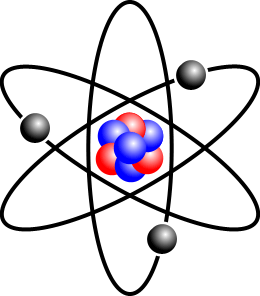
Nella figura i protoni sono indicati in rosso, gli elettroni in nero ed i neutroni in blu.
Anche se l’atomo possiede delle cariche elettriche, essendo il numero degli elettroni sempre uguale al numero dei protoni, la carica complessiva dell’atomo è 0. Perciò ogni atomo preso singolarmente è elettricamente neutro.
Ogni sostanza esistente in natura, è riportata nella tavola periodica degli elementi, una sorta di mini Bibbia per il chimico, dove vengono suddivisi tutti gli elementi secondo le loro caratteristiche atomiche. Ciò che differenzia i vari elementi sono il numero di queste particelle, protoni, neutroni ed elettroni (ad esempio l’atomo del ferro (FE) ha 26 protoni, 26 elettroni e 28 neutroni, mentre quello del rame (CU) ha 29 protoni, 29 elettroni e 34 neutroni).
Questa rappresentazione dell’atomo venne ipotizzata dal Fisico Niels Bohr agli inizi del novecento e successivamente perfezionata insieme ad altri scienziati, fino a giungere alla conclusione che gli orbitali non sono in realtà delle orbite circolari o ellittiche che danno un percorso definito all’elettrone, in quanto gli elettroni si allontanano e si avvicinano al nucleo a velocità altissime in uno spazio dove si ha un’alta probabilità di trovare l’elettrone.
Perciò il modello “planetario” dell’atomo della figura precedente andrà sostituito con un modello diverso, dove il nucleo è circondato da una nube elettronica la cui dimensione definisce il diametro dell’atomo.

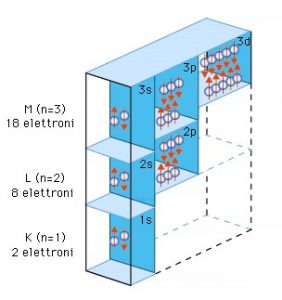
Ora proverò a descrivere la struttura degli questi orbitali e come si dispongono gli elettroni all’interno di essi, se a qualcuno dopo qualche riga comincerà a confondersi le idee, niente paura al termine utilizzerò un’analogia che sicuramente sarà molto utile a chi perderà la bussola nella successiva descrizione.
Gli orbitali vengono definiti con dei numeri chiamati numeri quantici.
- Il primo numero quantico si indica con la lettera n, ed identifica la dimensione dell’orbitale e può variare da 1 a 7, più il numero è grande più è grande l’orbitale.
- Il secondo numero quantico si indica con la lettera l invece identifica la forma dell’orbitale, il valore di questo numero dipende dal primo numero quantico, il suo valore va da 0 a n-1. Con il valore 0 si intende un orbitale sferico, con gli altri valori invece si intendono orbitali di forma differente non sferica. Ad ogni forma di orbitale viene associata una lettera e cioè:
l=0 orbitale s 
l=1 orbitale p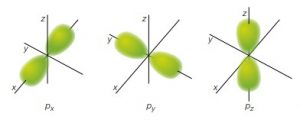
l=2 orbitale d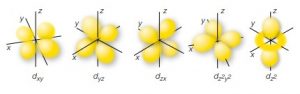
l=3 orbitale f
(immagini tratte dal “Chimicafacile ” ed. Zanichelli)
- Il terzo numero quantico rappresenta l’orientamento dell’orbitale nello spazio e si indica con la lettera m e può assumere valori compresi tra -l e +l. Se l’orbitale è sferico (l=0) allora m=0, ma se l=1 allora m potrà valere -1,0,+1, che sono 3 valori che indicano l’orientamento dell’orbitale secondo i 3 assi cartesiani dello spazio x,y, e z. Se invece l=2 esisteranno 5 possibili diversi valori di m che identificano 5 diversi orbitali -2,-1,0,+1,+2.
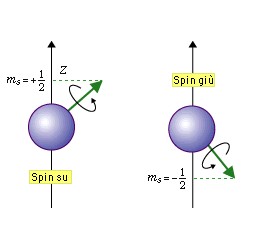
- Il quarto numero quantico indica lo spin, cioè il verso di rotazione dell’elettrone su se stesso, questo numero può assumere due valori +1/2 e -1/2, e se in un orbitale ci sono due elettroni essi dovranno avere il numero di spin differente.
(immagini tratte dal tutorial “Project energy-Technet” )
Ora che abbiamo descritto i numeri quantici cerchiamo di capire qualcosa di più sugli orbitali e su come si dispongono gli elettroni all’interno di essi.
In ogni orbitale possono disporsi due elettroni con spin differente, e a seconda del numero, gli elettroni si dispongono prima negli orbitali con un numero quantico n minore e via via in maniera crescente.
Facciamo un esempio in un atomo che ha 8 elettroni, si disporranno 2 elettroni nel primo orbitale identificato dalla lettera n=1 che non ha altri numeri quantici perché essendo l=0 l’orbitale è sferico. Poi si disporranno altri 2 elettroni nel secondo orbitale di tipo s corrispondente al numero quantico n=2, ed essendo n=2 si ha che l potrà valere +1,0 e -1 pertanto ci sono 3 possibili orbitali p con differente orientamento ed in questi 3 orbitali si potranno disporre 4 elettroni, due nel primo orbitale di tipo p ed 1 elettrone per ognuno degli altri due orbitali.
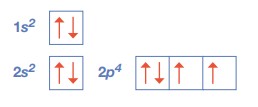
(immagini tratte dal “Chimicafacile ” ed. Zanichelli)
Questa spiegazione è forse un po’ troppo dettagliata ma era doverosa. Per chi ha perso la bussola come ho detto inizialmente c’è un esempio che può spiegare in maniera più facile la disposizione degli elettroni nei vari orbitali.
(immagini tratte dal tutorial “Project energy-Technet” )
In pratica è come se avessimo un’abitazione su più piani, dove in ogni piano ci sono più appartamenti disposti però in livelli differenti. Gli elettroni occuperanno i vari appartamenti partendo dal piano terra, spostandosi via via in alto. In ogni piano gli appartamenti rappresentano le diverse forme di orbitali. Gli elettroni più lontani dal nucleo (quelli più in alto nell’abitazione) hanno una maggiore energia. Un po’ come avviene realmente in un palazzo su più piani, più aumenta l’altezza più aumenta l’energia potenziale del corpo che in caso di caduta verrebbe restituita sotto forma di “energia di movimento” (energia cinetica per essere esatti).
Gli “appartamenti” corrispondenti ad l=0 con l’orbitale sferico s, possono contenere solo due elettroni Quelli corrispondendi ad l=1 con l’orbitale p, possono invece contenere 6 elettroni 2 per ogni orbitale orientato diversamente, e quelli corrispondenti ad l=2 con l’orbitale d, possono contenere 10 elettroni, 2 elettroni per ogni orbitale orientato diversamente. In ogni orbitale la coppia di elettroni dovrà avere spin opposto.
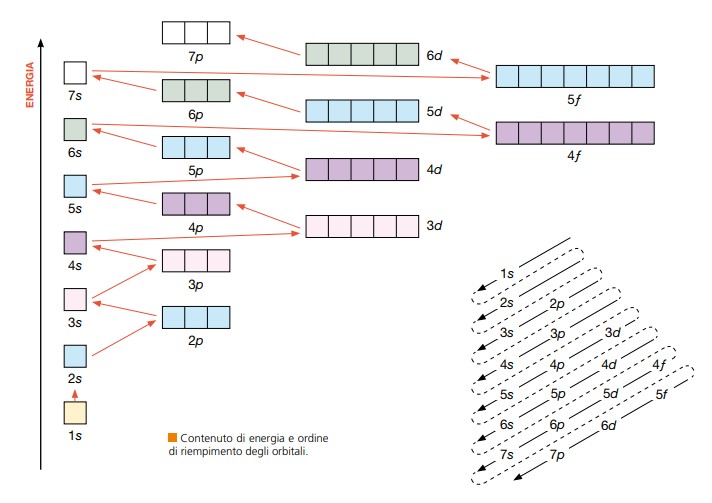
(immagini tratte dal “Chimicafacile ” ed. Zanichelli)
In base al numero di elettroni, gli orbitali verranno riempiti secondo l’ordine crescente di energia degli orbitali in figura. Ad esempio un atomo con 15 elettroni avrà la seguente configurazione:
- livello 1s=2 elettroni
- livello 2s=2 elettroni
- livello 2p=6 elettroni (2 per ogni orbitale)
- livello 3s=2elettroni
- livello 3p=3 elettroni (1 per ogni orbitale)
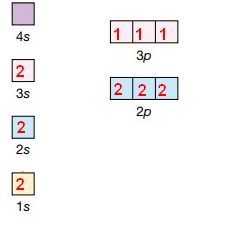
Gli elettroni appartenenti agli strati esterni incompleti vengono chiamati elettroni di valenza, e sono quelli responsabili del legame tra atomi.
Il discorso cambia un po’ però quanto consideriamo una struttura con più atomi, come avviene nella realtà.
In un solido conduttore gli atomi si dispongono secondo una configurazione reticolare, a distanze uguali ed avvicinando gli atomi avviene che gli elettroni più esterni, perdono memoria del loro atomo di appartenenza e si dispongono in un’unica nube di elettroni in tutto il solido.
Infatti partendo da atomi singoli che non interagiscono tra di loro, avvicinando gli atomi tra di loro la nube degli elettroni di valenza più esterna si fonde fino a diventare un’unica nube elettronica in tutto il solido.

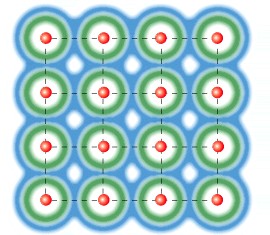
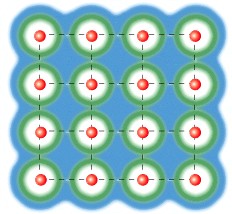
(immagini tratte dal tutorial “Project energy-Technet” )
Per il principio di esclusione di Pauli (che afferma l’impossibilità di avere due elettroni con lo stesso livello energetico) quando avviciniamo gli atomi tra di loro (e gli elettroni cominciano ad occupare una nube elettronica che interessa l’intero nucleo) varierà leggermente il livello energetico di ogni elettrone, che non sarà più rappresentato da una linea netta, ma da una banda di valori.
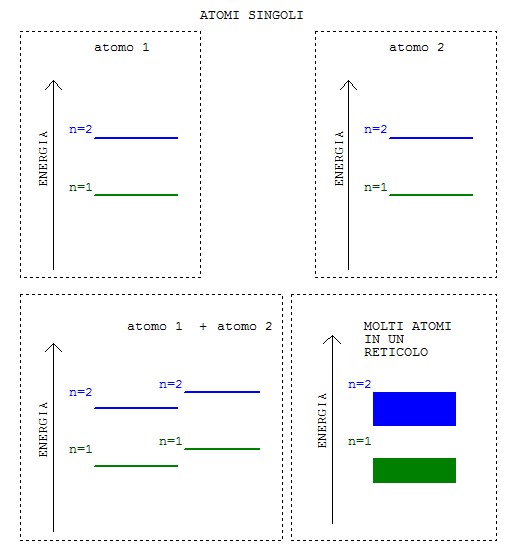
I due livelli energetici posseduti dagli elettroni degli orbitali di colore verde e blu erano ben definiti quando gli atomi erano isolati tra di loro, ma avvicinando gli atomi, gli elettroni con lo stesso livello energetico si trovano insieme ad altri elettroni con lo stesso livello di energia e ciò secondo il principio di esclusione di Pauli non può avvenire. Pertanto essi cambieranno leggermente il proprio livello energetico creando in questo modo delle bande di energia, cioè non più dei livelli ben definiti di energia, ma degli intervalli.
Possiamo distinguere essenzialmente due bande; quella di valenza e quella di conduzione. La prima è quella più vicina al nucleo con un energia minore ed è totalmente occupata dagli elettroni, la seconda invece è quella più lontana e non è totalmente occupata da elettroni.
Nei conduttori quando si crea il reticolo cristallino e si formano le bande di energia, la banda di valenza va a sovrapporsi a quella di conduzione, dando luogo ad una maggiore disponibilità di elettroni mobili in tutto il solido.
Nei semiconduttori le due bande rimangono separate da un piccolo intervallo (GAP) di energia, ed è possibile far saltare gli elettroni dalla banda di valenza a quella di conduzione.
Negli isolanti il GAP è molto grande e non ci sono elettroni liberi disponibili.
![]()
Ma cosa c’entra tutto questo con la corrente elettrica? C’entra e poi molto, perché la corrente elettrica altro non è che un flusso di cariche elettriche, e le uniche cariche elettriche che possono spostarsi in un conduttore sono gli elettroni. Lo spostamento potrà avvenire solo in presenza di una forza elettrica esterna applicata sul conduttore.
Facendo un’analogia con i liquidi, possiamo considerare un cilindro pieno di acqua un cilindro vuoto ed uno semivuoto posti orizzontalmente. Provate a spostare i 3 cilindri in verticale, nei primi due casi non accadrà nulla, nel terzo caso il cilindro semivuoto, l’acqua si sposterà verso il basso causando un istantaneo movimento (flusso).
Nei metalli avviene lo stesso, se applico una forza elettrica tramite altre cariche elettriche su un conduttore, avviene che, essendo il livello energetico più esterno non completo, le cariche verranno attratte dalla carica positiva e respinte da quella negativa spostandosi da una parte all’altra creando così un flusso di cariche e cioè una corrente elettrica.
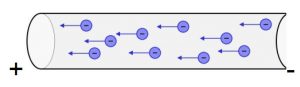
Nel prossimo articolo descriveremo meglio la corrente elettrica e le altre grandezze fondamentali.
Grazie per l’attenzione.